Antwort Kolik atomových orbitalu je ve vrstvě N 2? Weitere Antworten – Kolik je vrstev v atomu

Atomy dosud známých prvků obsazují elektrony 7 elektronových vrstev, které se označují čísly 1 až 7 nebo písmeny K,L,M,N,O,P,Q. Maximální počet elektronů v každé vrstvě se rovná dvojnásobku počtu orbitalů, protože v jednom orbitalu mohou být maximálně dva elektrony.Uvedeme nejdřív hlavní kvantové číslo, potom symbol vedlejšího kvantového čísla a na závěr počet elektronů (píšeme jako exponent). Rámečky obsahují tolik políček, kolik orbitalů příslušného typu existuje.Atom může mít 1 – 7 elektronových vrstev.

Jak jdou za sebou orbitaly : Orbitaly se obsazují podle rostoucí energie v pořadí: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, … S tímto pořadím zcela koresponduje uspořádání prvků v periodickém systému.
Kolik atomových orbitalů je ve vrstvě N 2
v první periodě se nacházejí pouze dva prvky, tj. vodík a helium. Hlavnímu kvantovému číslu dvě odpovídají dvě hodnoty vedlejšího kvantového čísla (n = 2, l = 0 a 1). Druhá elektronová vrstva obsahuje orbitaly typu s a p, k jejichž úplnému zaplnění je třeba 8 (2 + 6) elektronů.
Kolik elektronů může být v první vrstvě : Počty elektronů ve slupkách
| Název slupky | Název podslupky | Maximální počet elektronů ve slupce |
|---|---|---|
| K | 1s | 2 |
| L | 2s | 2 + 6 = 8 |
| 2p | ||
| M | 3s | 2 + 6 + 10 = 18 |
protonové (atomové) číslo Z – je rovno počtu protonů v jádře, udává také počet elektronů obíhajících kolem jádra.
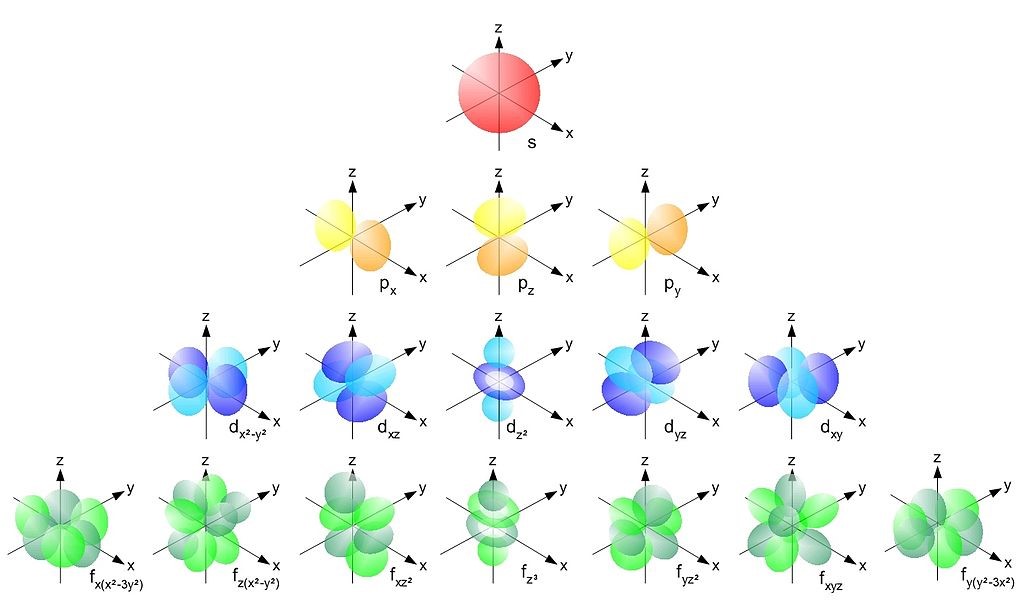
Elektronový obal je systém elektronů vázaných k jádru atomu, které obklopuje a zaujímá většinu prostoru atomu. Poloměr elektronového obalu (a tedy celého atomu) se pohybuje kolem 10−10 m a jeho hmotnost tvoří okolo 0,01 % celkové hmotnosti atomu.
Jak se zaplňují orbitaly
Výstavbový princip (tzv. Aufbau princip) říká, že orbitaly s nižší energií se zaplňují elektrony dříve než orbitaly s energií vyšší. V základním stavu atomu tedy elektrony obsazují jednotlivé slupky a podslupky tak, aby měly co nejnižší energii.Spinové kvantové číslo m s
| Kvantové číslo | Poznámka | |
|---|---|---|
| hlavní n | vedlejší l | |
| 4 | 1 | ve sféře jsou 3 orbitaly p |
| 2 | ve sféře je 5 orbitalů d | |
| 3 | ve sféře je 7 orbitalů f |
Elektrony (e-) jsou subatomární částice, které nesou záporný náboj. Nacházejí se v elektronovém obalu, který obklopuje atomové jádro. Elektronový obal zabírá většinu prostoru atomu, ale podílí se jen nepatrně na celkové hmotnosti atomu. V elektroneutrálním atomu je počet elektronů roven počtu protonů.
Počet elektronů ve slupce nejdále od jádra určuje reaktivitu atomu neboli sklon k vytváření vazeb s ostatními atomy. Tato slupka nejdále od jádra se nazývá valenční slupka a elektrony, které se v ní nacházejí, se nazývají valenční elektrony.
Jaký prvek má 8 elektronů : V této tabulce vidíme, že helium má zcela zaplněnou valenční slupku, tedy dva elektrony v své první a jediné slupce 1n. Podobně je tomu u neonu, který má osm elektronů v jeho valenční slupce 2n. Tyto elektronové konfigurace jsou zodpovědné za to, že helium a neon jsou velmi stabilní.
Jak zjistit počet elektronů : V neutrálním atomu je počet protonů stejný jako počet elektronů, a proto počet elektronů můžeme snadno určit z atomového čísla. Navíc pozice prvku v periodické tabulce—sloupec, skupina, řádek nebo perioda—poskytují užitečné informace o uspořádání elektronů ve slupkách.
Co je to atomové číslo
protonové (atomové) číslo Z – je rovno počtu protonů v jádře, udává také počet elektronů obíhajících kolem jádra. nukleonové (hmotnostní) číslo A – je rovno počtu nukleonů v jádře, tj. A = Z + N.
V této tabulce vidíme, že helium má zcela zaplněnou valenční slupku, tedy dva elektrony v své první a jediné slupce 1n. Podobně je tomu u neonu, který má osm elektronů v jeho valenční slupce 2n. Tyto elektronové konfigurace jsou zodpovědné za to, že helium a neon jsou velmi stabilní.Seznam všech objevených prvků
| Český název | Latinský název | Protonové číslo Z |
|---|---|---|
| helium | helium | 2 |
| hliník | aluminium | 13 |
| holmium | holmium | 67 |
| hořčík | magnesium | 12 |
Kolik prvků obsahuje 2 perioda : Nová perioda naznačuje opakování vlastností (tzn. prvky s podobnými vlastnostmi jsou v sloupečku pod sebou). Druhá perioda obsahuje tyto prvky: lithium, beryllium, bor, uhlík, dusík, kyslík, fluor a neon.