Antwort Jaká je molární koncentrace vody? Weitere Antworten – Jakou koncentraci má voda
Tvrdost vody ve Dvoře Králové nad Labem
| VODA | mmol/l | °N |
|---|---|---|
| měkká | 0,5 – 1,25 | 2,8 – 7,0 |
| středně tvrdá | 1,26 – 2,5 | 7,1 – 14,0 |
| tvrdá | 2,51 – 3,75 | 14,1 – 21,0 |
| velmi tvrdá | >3,76 | >21,1 |
Výpočty látkové (molární) koncentrace
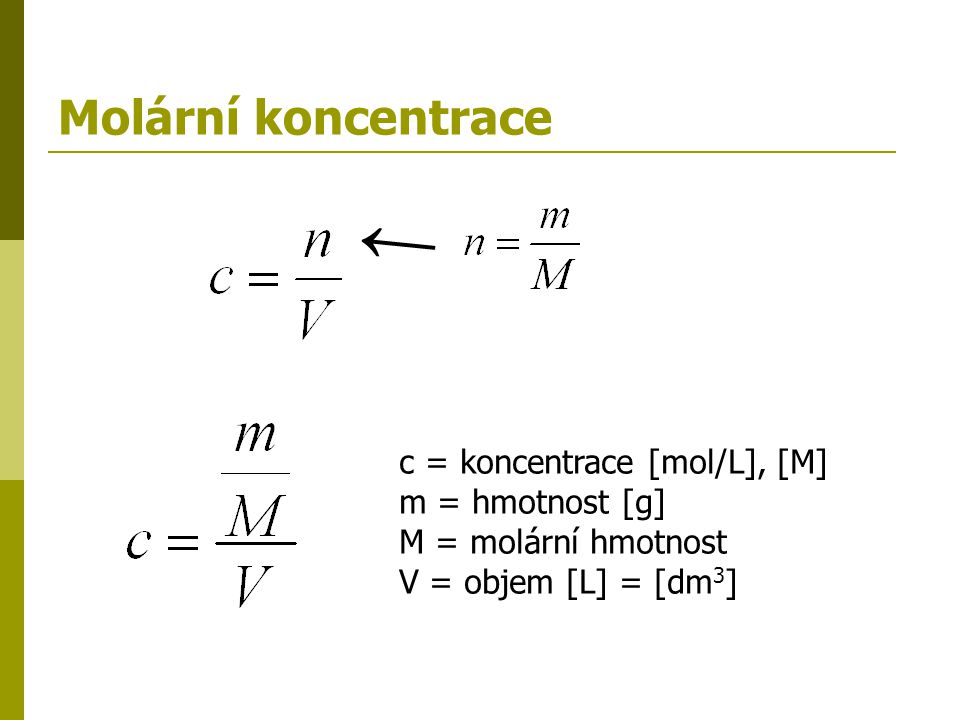
c = n/V. Obvykle se látková koncentrace vyjadřuje v jednotkách mol/l (mol dm–3) a můžeme se setkat se starším značením 1 mol/l = 1 M. Vypočítejte látkovou koncentraci NaCl ve 200 ml roztoku, na jehož přípravu jsme použili 10 g NaCl (M = 58,44 g/mol).Látková koncentrace (též molární koncentrace nebo molarita) je rovna podílu látkového množství látky obsažené v soustavě ku objemu této soustavy: c = n V {\displaystyle c={\frac {n}{V}}}
Jaká je molární koncentrace 30% kyseliny chlorovodíkové : Odpověď: Molární koncentrace 30% kyseliny chlorovodíkové je 9,46 mol⋅dm-3.
Jaké je skupenství vody
Vodu najdeme na Zemi v pevném, kapalném i plynném sku- penství. Ve skupenství pevném, jako je led, sníh nebo jinovatka, se vyskytuje především v místech, kde je teplota nižší než 0 °C. Právě při 0 °C se začíná kapalná voda měnit na vodu pevnou. Tato změna může být velmi nebezpečná pro rostliny a živočichy.
Jaká je molární hmotnost vody : 18,01528 g/molVoda / Molární hmotnost
Vycházeli jsme přitom z mylného předpokla-du, že molární množství vody ve vodném roztoku je molárním množstvím molekul H2O (hmotnost dělená hmotností jedné molekuly H2O). V jednom kilogramu čisté vody jsme tedy počítali s 55.508 mol vody, protože molární hmotnost H20 je 18.01528 g/mol.
Objemová a hmotnostní procenta – udávají počet dílů rozpuštěné látky ve 100 dílech roztoku (například 5% roztok chloridu sodného obsahuje 5 g NaCl a 95 g H2O)
Pokud I litr roztoku obsahuje 1 mol rozpuštěné látky, c = 1 mol. dm-3, roztok označíme jako tzv. jednomolární roztok (1M). m – hmotnost látky; V – objem látky; M – molární hmotnost látky; Vm – molární objem látky.
Co je to 1 mol
Jednotkou látkového množství je 1 mol. mol Jeden mol je takové látkové množství, které obsahuje stejný počet částic, jako je počet atomů uhlíku v 12 g nuklidu 12C. Částice musí být vždy specifikována, nejčastěji v závorce za symbolem látkového množství látky, a může jí být molekula, atom, ion, elektron apod.2M znamená, že roztok je dvoumolární, tedy s koncentrací 2 mol/dm3. Je možné použít i násobných předpon, např. mM pak znamená milimolární (mmol/dm3), μM znamená mikromolární (μmol/dm3) atd. Tento způsob vyjadřování koncentrace se velmi často používá v analytické chemii.Na přípravu 500 ml 10 % HCl je potřeba: 124,6 ml 35 %-ního roztoku HCl a 366,1 ml vody.
Voda pokrývá více než 71 % zemského povrchu. Více než 97 % plochy vodstva pokrývají moře a oceány, oproti tomu sladká voda tvoří pouze 3 % hydrosféry.
V jakém skupenství má voda největší hustotu : Hustota. Největší hustotu nemá led, ale tekutá voda při 3,95 °C, dalším snižováním teploty se objem jednotkové hmotnosti vody zase zvětšuje.
Kolik je 1 mol : Mol (značka mol) je základní fyzikální jednotka látkového množství. Jeden mol libovolné látky obsahuje přesně 6,02214076×1023 částic (atomů, molekul, iontů apod.), což je číselná hodnota Avogadrovy konstanty vyjádřené v jednotkách mol−1.
Jak zjistit molární hmotnost
Molární hmotnost definujeme jako podíl hmotnosti dané látky a jejího látkového množství. Vyjadřuje nám, jaká hmotnost připadá na jeden mol látky. Vypočítáme ji ze vztahu M_m = \frac {m} {n}. Její jednotkou je kg .
100/80 = 31,25% Page 5 3) 10% roztok obsahuje 10 g rozpuštěné látky a 90 g rozpouštědla.l-1). Pokud I litr roztoku obsahuje 1 mol rozpuštěné látky, c = 1 mol. dm-3, roztok označíme jako tzv. jednomolární roztok (1M).
Kolik je 1 mol vody : Vycházeli jsme přitom z mylného předpokla-du, že molární množství vody ve vodném roztoku je molárním množstvím molekul H2O (hmotnost dělená hmotností jedné molekuly H2O). V jednom kilogramu čisté vody jsme tedy počítali s 55.508 mol vody, protože molární hmotnost H20 je 18.01528 g/mol.